ORBITAL DAN PERANANNYA DALAM IKATAN KOVALEN
A. SIFAT GELOMBANG
Pada tahun 1923, seorang mahasiawa
asal perancis yaitu Louis Brougli, ia menggemukakan pendapat yang refolusioner
bahwa electron mempunyai sifat gelombang dan skaligus memiliki sifat partikel.
Pendapatnya tersebut kini di jadikan sebagai konsep mekanika kuantum mengenai
gerak electron dan teori orbital molekul.
Berdasarkan
geraknya tersebut dibagi menjadi 3 yaitu:
·
1. Dimensi à orang yang sedang memetik gitar yang kedua ujungnya mati
·
2. Dimensi àpermukaan kepala drum
·
3. Dimensi à system gelombang electron
Di
dalam gelombang terdapat suatu tinggi gelombang diam yaitu Amplitudonya, yang dapat mengarah ke atas (nilai positif) atau
mengarah kebawah (nilai negative) terhadap kedudukan isytirahat dari sinar. (
tanda + atau – dari amplitude bukanlah
muatan listik melainkan tanda
metematik). Kedudukan pada gelombang yang amplitudonya nol disebut simpul.
Dua
gelombang diam dapat sefase atau keluar fase yang satu dengan yang lain .
apabila amplitudo positif dan negative dari dua gelombang tersebut searah kedua gelombang tersebut dapat di katakan sefase. Namun apabila tanda matematik
dari amplitudo saling berlawanan , maka gelombang bukan sefase
Apabila
terdaoat dua gelombang yang sefase pada sinar yang sama saling tumpang tindih,
maka hal tersebut akan saling memperkuat. Begitu juga sebaliknya, apabila
sepasang gelombang yang tumpang tindih yang keluar fase , maka akan saling mengganggu atau berinterferensi. Proses
interverensi menyatakan penambahan dua fungsi matematik yang berlawanan arah. Tumpang tindih sebagian dari
dua gelombang yang keluar fase menghasilkan sebuah simpul.
Beberapa gambar tentang gelombang :




Ikatan Sigma dan Ikatan Pi




1.
1. Ikatan sigma (σ)
Ikatan
sigma (σ) merupakan ikatan kovalen yang terbentuk akibat tumpang tindih
orbital-orbital ujung ke ujung, dengan kerapatan electron yang terkonsentrasi
diantara inti atom yang berikatan. Di dalam ilmu kimia, ikatan sigma (σ)
merupakan sejenis ikatan kimia kovalen yang paling kuat.
Ikatan
dalam H2 hanya satu dari sekian banyak ikatan sigma yang dijumpai.
Ikatan sigma dapat dijelaskan dengan jelas untuk molekul diatomic menggunakan
konsep grup simetri. Ikatan sikma adalah simetri terhadap rotasi di sumbu ikat.
Berdasarkan definisi tersebut ikatan sigma yang umum adalah s+s, pz+pz,
s+pz, dan dz2+ dz2.
Teori kuantum juga mengatakan bahwa orbital molekulyang bersimetri sama akan
bercampur.

2 2.
Ikatan pi (π)
Ikatan
pi (π) adalah ikatan kimia kovalen yang dua cuping orbital atom yang
berelektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya
yang juga berelektron tunggal. Hanya terdapat satu bidang simpul dari orbital
yang melewati dua inti atom. Ikatan pi (π)
biasanya lebih lemah dari ikatan sigma karena rapatan electronnya lebih
jauh dari inti atom yang bermuatan positif, sehingga memerlukan lebih banyak
energy. Jika, dilihat dari sudut pandang mekanika kuantum, kelemahan ikatan ini
dijelaskan oleh ketumpang tindihan yang sangat sedikit diantara orbital p oleh
karenanya orientasinya yang parallel.

B. ORBITAL IKATAN DAN ORBITAL ANTI IKATAN
Dalam gelombang apabila ada sepasang gelombang saling tumpang tindih,
maka sepasang gelombang tersebut dapat saling memperkuat atau saling
berinterferensi. Adanya penambahan dari dua orbital atom 1s dari dua atom H
yang sefase akan menghasilkan orbital molekul ikatan sigma dengan rapatan
electron yang tinggi antara inti yang diberikan.
Keadaan dimana terdapat dua gelombang
berlawanan fase, maka kedua gelombang tersebut saling mengganggu,
interferensi dari dua orbital atom yang
keluar fase dari dua atom hydrogen memberikan orbital molekul dengan simpul antara inti. Dalam orbital molekul
ini menentukan, kebolehjadian tersebut menentukan electron antara inti yang sangat
rendah. Karena itu, orbital molekul ini menimbulkan sistem dimana inti tidak
dilindungi oleh sepasang electron, dan intinya pun saling tolak-menolak. Karena
tolakan tersebut, inti sistem ini energinya lebih tinggi dari pada sistem dua
atom H yang mandiri. Orbital yang lebih tinggi ini disebut orbital anti-ikatan.
Khusus
untuk molekul hydrogen H2, orbital σ dan σ* ada dalam daerah ruang
umum yang sama. Orbital bukan materi, tetapi daerah ruang biasa dengan
kebolehjadiannya untuk menemukan electron dengan energy khas yang tinggi. Dalam
setiap keadaan, molekul ikatan mempunyai energy yang lebih rendah dari pada energy
aom non-ikatan , dan molekul dengan ikatan electron dalam orbital anti-ikatan
mempunyai energy yang lebih tinggi dari pada atom non ikatan. Suatu molekul
dinyatakan berada dalam keadaan bereksitasi bila satu atau lebih electron tidak
ada dalam orbital energy. Energy ini dapat di nyatakan menurut diagram berikut :


Pada
dasarnya, semua orbital molekul ikatan mempunyai orbital anti-ikatan yang
berhubungan dengannya. Molekul dengan electrode dalam orbital molekul ikatan
mempunyai energy yang lebih rendah dari
pada energy atom non-ikatan, dan molekul dengan electron dalam orbital
anti-ikatan mempunyai energy yang lebih tinggi dari pada atom non-ikatan. Suatu
molekul dikatan dalam keadaan bereksitasi
apabila satu atau lebih electron tidak ada dalam orbital energy terendah.
Berikut
ini disimpulkan beberapa aturan umum yang dapat diterapkan terhadap semua
orbital molekul, dan tidak hanya terhadap orbital molekul H2,
diantaranya adalah:
a.
Setiap orbital (molekul atau atom)
dapat memegang maksimum dua dua electron yang harus mempunyai spin yang
berlawanan.
b.
Jumlah orbital molekul sama dengan
jumlah orbital atom yang digunakan dalam pembentukannya.
c.
Dalam pengisian orbital molekul
dengan electron, orbital berenergi terendah dan diisi dahulu. Bila duua orbital
tergenerasi dari energy yang sama, masing-masing mendapat satu electron sebelum
salah satu orbital terisi penuh.
C. ORBITAL HIBRIDA
KARBON
Ada empat orbital atom pada tingkat
energy kedua : satu orbital 2s dan tiga
orbital 2p.
Namun
demikian, karbon tidak digunakan keempat orbital dalam keadaan murninya untuk
ikatan , sebagai gantinya karbon
bercampur , atau berhibridasi, yaitu empat orbital atom tingkat kedua menurut
salah satu dari tiga crara untuk ikatan:
1. Gibridisasi
sp3, digunakan bila karbon membentuk empat ikatan tunggal
2. Hibridisasi
sp2, digunakan bila karbon membentuk ikatan rangkap
3. Hibridisasi
sp, digunakan bila karbon membentuk ikatan ganda tiga atau ikatan rangkap
terkumulasi (dua ikatan-rangkap terhadap suatu atom karbon tunggal)
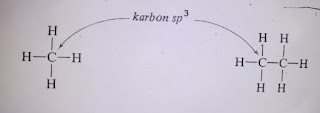
A.Hibridisasi sp3
Hibridisasi
sp3 pada atom C
Struktur konfigurasi elektron keadaan
dasar atom karbon (6 elektron) dan atom hidrogen (1 elektron) dapat digambarkan
sebagai berikut:
Apabila dilihat dari struktur
konfigurasi atom karbon tersebut maka seharusnya dapat ditemukan senyawa CH2,
namun senyawa yang paling sederhana dikenal di alam adalah CH4(metana). Bentuk
molekul metana adalah tetrahedral yang dapat digambarkan sebagai beriku
Struktur tetrahedral memiliki sudut
H-C-H sebesar 109°28′, dengan panjang ikatan dan kekuatan
ikatan keempat ikatan C-H ekivalen.
Untuk
menjelaskan bentuk struktur tetrahedaral dari metana CH4 dapat dilakukan dengan
hibridisasi. Hibridisasi 1 orbital 2s
dengan 3 orbital 2p menghasilkan 4
orbital hibrid sp3 yang
energinya sama (lebih tinggi dari energi orbital 2s dan lebih rendah dari
energi orbital 2p) dan masing-masing baru terisi 1 e- → atom C dapat mengikat 4 atom H dan
membentuk CH4 (4 ikatan σ).
Bentuk orbital hibrid sp3
dapat digambarkan sebagai berikut:
Bentuk molekul, sudut ikatan H-C-H
serta panjang dan kekuatan ikatan C-H dalam metana dapat digambarkan sebagai
berikut:
Sudut
ikatan ideal 109°28′ hanya diperoleh bila keempat gugus
atom yang terikat pada C adalah identik. Bila substituen tidak identik sudutnya
dapat mengalami deformasi, seperti pada senyawa (CH3)2CH2 yang menunjukkan
sudut H-C-H 1070.
b.Hibridisasi
sp2
pada atom C
Bila
suatu karbon berikatan rangkap dua dengan atom lain, maka hibridisasi yang
terjadi adalah 2sp2,
dimana orbital 2s dihibridkan dengan
2 orbital 2p menghasilkan 3 orbital
hibrid sp2.
Contoh : dalam etena (C2H4)
Pembentukan hibridisasi sp2 dari atom karbon dapat
digambarkan sebagai berikut:
Overlapping antara orbital hibrid sp2 dari atom C dengan orbital
sp2 dari atom C yang
lain atau dengan orbital sp3 dari atom lain, atau
dengan orbital s dari hidrogen atau
orbital p dari atom halogen,
misalnya, akan menghasilkan ikatan sigma
(σ), sedang overlapping
(secara lateral) antara orbital 2p
yang tak terhibridisasi pada masing-masing C yang mengalami hibridisasi sp2 akan menghasilkan ikatan pi (π).
bentuk molekul etena C2H4
Bentuk molekul etena adalah planar,
dengan sudut H-C-H dan H-C-C kira-kira 120o, dengan awan elektron
terletak di atas dan di bawah bidang planar.












materi yang anda sampaikan sudah bagus, tetapi gambar yang anda masukkan harus dengan jelas. terimakasih.
BalasHapusSelamat sore saudari lutvia saya ingin bertanya pada bagian ini bisa kah anda jelaskan kembali dengan singkat dari maksud pernyataan ini "molekul ikatan mempunyai orbital anti-ikatan yang berhubungan dengannya." jika bisa disertakan dengan penjelasan gambar, trimakasih 😊
BalasHapusMaterinya sudah lengkap, namun bisakah anda memberikan gambaran yang lain untuk ikatan phi dan sigma? karena saya kurang mengerti dengan gambar yang diatas. terimakasih
BalasHapusmateri dari saudari lutvia sangat dimengerti , terima kasih yaa atas materinya :)
BalasHapus